RESEARCH最新の研究内容
第47回ヨーロッパ骨髄移植会議(EBMT2021)の話題から research
第47回ヨーロッパ骨髄移植会議(EBMT2021)の話題から
小島勢二
EBMT2021は3月14日から17日までの期間WEB開催されました。昨年に続いてCAR-T療法や遺伝子治療に関する演題を中心に最新の情報を紹介します。EBMTにはヨーロッパを中心に71ヶ国から577の移植施設が参加しており、毎年50,000件の移植データが集められています。昨年、上海にEBMT China事務所が開設され、EBMTの中国重視の姿勢が伝わってきます。
世界各国におけるアカデミックCAR-T製剤の開発状況
中国、イスラエル、日本、ブラジルの演者が参加して、各国におけるアカデミックCAR-T製剤の開発状況が報告されました。中国では、多くの移植施設やベンチャーがCAR-T製剤を製造しており、とりわけBCMA抗原を標的とした多発性骨髄腫のCAR-T療法を多数の施設で実施しています。治療抵抗性悪性リンパ腫を対象に、自家造血幹細胞移植(HSCT)に続いてCD19-CAR-TとCD22-CAR-Tを併用することで90%の患者に寛解が得られていますが、CAR-T投与を先行して、自家HSCTを地固め療法として施行することも行われています。
杭州にある浙江大学では、再発/治療抵抗性悪性リンパ腫に対して、CAR-Tを投与して寛解を得てから末梢血採取を行い自家HSCT行うと同時に、さらに採取した末梢血から製造したCAR-Tで地固め療法を行うという臨床研究を行っています。安価なCAR-T製剤を入手できることで、初めて実施可能な治療法です。
イスラエルのSheba Medical Centerは2000床ある中東で最も先進的な医療施設ですが、自施設で製造したCD19-CAR-T製剤による臨床研究を行っています。これまで、90人の患者が研究に参加しましたが、1人を除いて、全員において9~10日でCAR-Tの製造が可能でした。これまで、日本で使用されているノバルテイスのキムリアは米国で製造するので、リンパ球を採取してから製剤が入手できるまでに1~2ヶ月かかっていましたが、自施設で製造するメリットは大きいと考えられます。今後、キムリアは国内で製造されるので、リンパ球を採取してから投与するまでの期間が短縮するのではないかと思います。なお、急性リンパ性白血病では30/36(83%)で、悪性リンパ腫では32/52(62%)で完全寛解あるいは部分寛解が得られました。
中南米諸国では、高額なコマーシャルCAR-T製剤の使用例はいまだありません。ブラジルにおいては、年間4200件の造血幹細胞移植が行われていますが、CAR-T治療は行われていませんでした。サンパウロにあるRibeirão Preto医科大学では、安価なCAR-T製剤の製造を計画し、GMPに準拠したレンチウイルスベクターの製造施設を設立しました。この施設で製造したCD-19-CAR-T製剤で、悪性リンパ腫患者に自家製CAR-T製剤による治療を開始しました。
日本からは、前日本造血細胞移植学会会長の岡本真一郎先生が、名古屋大学におけるpiggyBacトランスポゾン法を用いたCAR-T療法の臨床試験を紹介しました。
CAR-T治療後に同種造血幹細胞移植による地固め療法は必要か?
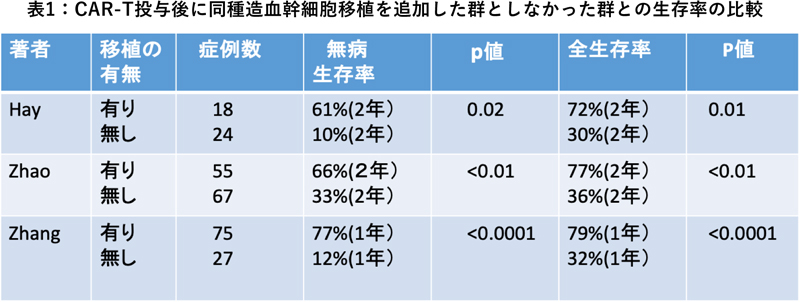
急性リンパ性白血病の非寛解にCD-19-CAR-Tを投与した場合、寛解は得られるものの、その後の再発が多いので多くの施設は同種移植による地固め療法を行っています。CAR-T治療後に同種移植を追加したグループと追加しなかったグループを比較した最近の報告では、いずれも、同種移植を追加することで生存率の向上が得られました(表1)。Jiangは文献をレビューして、同種移植を追加したグループでの再発率は27/203(13%)であったのに対し、追加しなかったグループの再発率は116/226(51%)であったと報告しています。
一方、同種移植を追加しても、生存率の向上は見られないという報告もあります。今回の学会でも、Sheba Medical Centerからの報告では、CAR-T療法後完全寛解が得られた9例において、同種移植を追加した5例では移植による合併症や再発のため生存例は2例のみでしたが、同種移植による地固め療法を受けなかった4例は全例が生存しています。
フィラデルフィア小児病院では、すでに400例のCAR-T治療を行っていますが、80~90%の患者は同種移植による地固め療法を受けていません。同種移植による地固め療法の適応を1)CAR-T投与28日後に次世代シークエンサーによる微小残存腫瘍(MRD)が陽性の場合、2)CAR-T投与6ヶ月以内に末梢血でB細胞の回復が見られた場合としています。B細胞の回復が見られた場合は、ノバルテイス社に連絡して、保存してあるCAR-Tを取り寄せて投与する場合もあるようです。その場合は、価格は請求されません。
名古屋大学でも次世代シークエンサーによるMRDを同種移植による地固め療法の適応の判断に用いています。
悪性リンパ腫に対するCAR-T治療:キムリアとイエスカルタの比較
日本で承認されたCD19-CAR-T製剤はこれまでノバルテイスのキムリアしかありませんでしたが、最近、イエスカルタが承認されました。イエスカルタは米国のカイトが開発したCAR-T製剤で、日本ではカイトと提携した第一三共が販売します。ウイルスベクターは米国から取り寄せますが、改変T細胞の培養は国内施設で行います。適応は悪性リンパ腫のみで、急性リンパ性白血病には適応がありません。キムリアは共刺激分子として4-1BBを用いていますが、イエスカルタはCD28を用いています。共刺激分子として4-1BBを用いた方が、CAR-Tの体内での持続期間が長い一方、増殖はCD28を用いた方がよい傾向があり、実際の治療成績に反映されるのか知りたいところです。
ドイツの悪性リンパ腫研究グループは、成人のびまん性大細胞型B細胞悪性リンパ腫を対象に、後方的にキムリアで治療された130例とイエスカルタで治療された137例の治療成績を比較しました。全体として全反応率は62%(完全反応:33%,部分反応:29%)でしたが、イエスカルタの全反応率は77%,キムリアの全反応率は46%でした。CAR-T投与1年後に病気の進行なく生存している割合(Progression free survival)も、34%対15%でイエスカルタが優れていました。一方、サイトカイン放出症候群(CRS)や神経毒性症候群(ICANS)はイエスカルタ群の方が多く見られました。
遺伝子治療に関するトピック
現在、4000件にも達する遺伝子治療の臨床研究が行われているのに、ヨーロッパで薬事承認されている遺伝子治療製剤はADA-重症複合免疫不全症、レーベル先天性網膜黒内障、異染性白質ジストロフィー、サラセミアに対する4つの製剤に過ぎません。遺伝子治療製剤の薬事承認システムを再考する必要があると思われます。
レンチウイルスベクターによる骨髄異形成症候群や急性白血病の発生
1990年代の後半に始まったレトロウイルスベクターによる先天性免疫不全症に対する遺伝子治療は、免疫能の回復が得られ有望な治療法として期待されましたが、骨髄異形成症候群(MDS)や白血病の発生が見られ、遺伝子治療の開発は下火になりました。とりわけ、ウイスコット・アルドリッチ症候群で7/10、慢性肉芽腫症では、2/2と高頻度にMDSや白血病の発生が見られました。遺伝子治療の再開は、安全とされるレンチウイルスベクターの開発まで待つことになりました。幸い、これまで行われたレンチウイルスベクターによる遺伝子治療では、MDSや白血病の発生は見られていません。
サラセミアや鎌状赤血球症は遺伝性ヘモグロビン異常症で、日本人には、ほとんど見られませんが、世界的には患者数が大変多い病気です。遺伝子治療に特化したバイオベンチャーであるBluebird Bioはサラセミアや鎌状赤血球症に対するレンチウイルスベクターによる遺伝子治療を開発し、すでに、サラセミアについては、ヨーロッパで薬事承認されています。
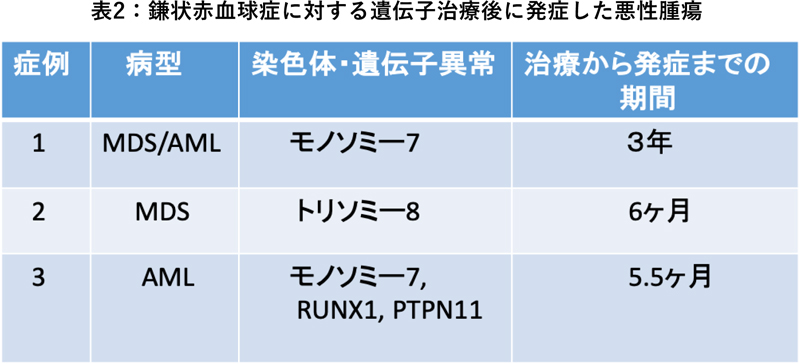
イタリアのLocatelliは今回の学会において、Bluebird Bioが行う鎌状赤血球症の治験に参加した患者から急性骨髄性白血病(AML)が2例、MDSが1例発生したことを報告しました(表2)。同じレンチウイルスベクターを使用していますが、サラセミアに対する遺伝子治療では、MDSや白血病の発症は見られていません。
サラセミアと鎌状赤血球症を対象にしたゲノム編集技術による遺伝子治療
これまでの遺伝子治療は、正常な遺伝子が働かない欠陥細胞に正常な遺伝子を導入してタンパクを作らせ、患者の必要とするタンパクを補充する治療法でした。一方、ゲノム編集技術を使えば、標的とする変異遺伝子を切断して希望する遺伝子配列を導入することで、遺伝子の改変が可能です。ベータサラセミアと鎌状赤血球症はともにHBB遺伝子の突然変異が原因で貧血が見られる病気ですが、胎児型ヘモグロビンが増えることで症状の改善が得られます。BCL11A遺伝子は、赤血球の胎児型ヘモグロビンの産生を抑制する転写因子ですが、CRISPER-Cas9によるゲノム編集技術を用いて、患者から採取したCD34陽性血液幹細胞に存在するBCL11A遺伝子の赤血球産生に関わるエンハンサー部位を改変し、この血液幹細胞をブスルファンによる前治療を受けた患者に輸注する遺伝子治療が行われています。
現在、CRISPERセラピューテイクス社とVertex社が、北米とヨーロッパで、上記の治験を行っていますが、今回の学会では遺伝子治療後3ヶ月以上観察された7人の輸血依存のサラセミアと3人の鎌状赤血球症の患者の臨床経過が報告されました。全例で、ヘモグロビン値と胎児型ヘモグロビン値の増加が見られ、最長21ヶ月間輸血が不要となっています。また、鎌状赤血球症の患者では血管閉塞による急性発作はみられておりません。重篤な副反応として、1人に血球貪食リンパ組織球症の合併が見られました。
副腎白質ジストロフィーに対する遺伝子治療
副腎白質ジストロフィー(ALD)は中枢神経の白質と副腎の障害を特徴とする遺伝性疾患で、X染色体に位置するABCD1遺伝子の変異が原因です。出生男児2万人に1人の頻度で見られます。血中の極長鎖脂肪酸の増加が診断の手掛かりとなります。小児大脳型では、3~10歳に、視力や聴力の異常、行動異常や成績の低下などの症状で発症し、以後、急速に進行して寝たきりとなってしまう予後不良な疾患です。治療として、造血幹細胞移植が選択されますが、症状が進んだ状態では、移植しても症状の改善が見られないことが多く、海外では、早期発見をめざして、本症の新生児マススクリーニングが行われています。
Bluebird Bioはレンチウイルスベクターを用いて、ABCD1遺伝子を患者の末梢血から採取したCD34陽性血液幹細胞に遺伝子導入する遺伝子治療を開発しました。ALD-102研究は、ブスルファンとシクロフォスファミドを前治療に用いましたが、現在はブスルファンとフルダラビンを前治療に用いるALD-104研究が進行中です。
ALD-102研究には北米やヨーロッパの施設から32人の患者がリクルートされ、すでに遺伝子治療後13~82ヶ月(中央値:38ヶ月)経過観察されています。プライマリーエンドポイントは、遺伝子治療開始後24ヶ月の時点で視覚障害やチューブ栄養などの主要な機能障害がなく生存していることですが、治療後24ヶ月経過した30人のうち27人はこの基準を達成しました。すでに、14人は5年以上経過観察していますが、観察期間を通して、上記の機能障害は見られていません。
セカンダリーエンドポイントの評価には1)25の評価項目を含む神経機能スコアー(NFS)とMRI画像を評価するLoesスコアーが使われました。NFSスコアーが評価された32人のうち31人では神経機能障害の進行は見られず、23人では、全く神経症状は見られませんでした。同様に、Loesスコアーでも、32人のうち、26人でMRI画像の悪化は見られませんでした。また、拒絶や2次性悪性腫瘍の発生などの重篤な副反応も見られませんでした。
ALD-104研究には、すでに19人が参加していますが、観察期間の中央値は8ヶ月で、効果の判定を報告するには時期尚早です。
関連記事

小児がんへの理解と支援のシンボルです
皆様からいただいた寄付金は、最新の診断方法や治療を小児がんの子どもたちに届けるために使われます。世界最高レベルの医療をすべての子どもたちに届けるため、皆様のご支援ご協力をよろしくお願いいたします。
寄付する