RESEARCH最新の研究内容
急性リンパ性白血病に対するキムリアのリアルワールドデータ research
米国血液学会ASH2019の報告から

小島 勢二
ASH2019は、2019年12月5日から10日まで、米国のオーランドで開催されましたが、世界中から30,000人を越える参加者がありました。
さて、2019年の5月に3,349万円でノバルテイス社のキメラ抗原受容体T細胞(CAR-T)製剤であるキムリアが薬価収載され、わが国でも臨床現場での投与が始まっています。そこで、昨年に続いて、ASH2019で発表されたCAR-T療法の最新情報を紹介します。
今回の学会ではCAR-T療法に関連して110の発表がありましたが、そのうち、75%がヒトを対象にした臨床研究の発表でした。国別の内訳は、米国が67,中国が30と2つの国が大半を占め、日本からは基礎研究が2つ発表されたのみでした。
これまでは、キムリアの臨床成績を知るには、治験の成績しかありませんでした。米国でキムリアが急性リンパ性白血病(ALL)に対して承認されたのは2017年の5月でしたが、今回の学会では市販後調査の発表がおこなわれ、いわゆるリアルワールドデータが始めて明らかになりました。
ALLに対するキムリアのリアルワールドデータ
全米の40病院で、159人のALL患者に投与されたキムリアのリアルワールドデータが、国際造血細胞移植データ登録機構(CIBMTR)で集計されました。
患者年齢は、0歳から25歳に分布し、その中央値は12歳でした。生存者における観察期間の中央値は5.8ヶ月で, キムリアに反応した割合は88%,キムリア投与開始6ヶ月後の無病および全生存率はそれぞれ68%、94%と治験の成績とほぼ同等でした。副作用としてのサイトカイン放出症候群や神経症状の発生は、13.3%、8.6%と治験と比べて大幅に減少しました。
リンパ球採取からキムリア輸注後2ヶ月間にかかる総医療費の平均は61万2779ドルと推定されましたが、キムリアの薬剤費(47万5000ドル)が、全費用の80%を占めています。
英国ではキムリア投与の適応は代表者会議で決定される
キムリアは2018年6月に欧州医薬品庁(EMA)でも承認されました。英国では、費用対効果の検討結果が確定するまでは、国民保険サービス(NHS)の抗がん剤基金(CDF)を通じての使用が推奨されています。
キムリアの適応は、毎週開催される臨床家、患者団体、CAR-T治療認定施設の代表で構成される会議(NCCP)で検討されます。適応ありと判定された患者は、全国7ヶ所の認定施設に振り分けられます。
2018年12月から2019年7月までの8ヶ月間に、46人の悪性リンパ腫の患者にキムリアの投与が認可されました。
再発・治療抵抗性ALL患者におけるCD19CAR-Tに対する反応予測因子
中国Hebei Yanda Lu Daopei病院では、2017年4月から2019年3月までの2年間に、254人の再発・治療抵抗性ALL患者が、CD19CAR-T製剤で治療されました。
投与30日後の時点で、89.4%(227/254)に 骨髄微小残存病変(MRD)が陰性の完全寛解(CR)が得られました。CRに至らないリスク因子を多変量解析で検討したところ、以下の5つのリスク因子が同定されました。
1)女性であること
2)白血病細胞におけるTP53変異の存在
3)骨髄の白血病細胞の割合が20%以上
4)副作用としての神経症状がみられないか軽症であること
5)共刺激分子として4-1BBでなくCD28の使用
ヨーロッパの小児造血幹細胞移植施設におけるCAR-T細胞の製造
イタリアのローマにあるIRCCS Bambino Gesu 小児病院とロシアのモスクワにあるDmitriy Rogachev国立医療センターは、ヨーロッパにおける最大級の小児血液病・がん専門病院です。Bambino Gesu小児病院は創立が1869年とたいへん歴史のある病院ですが、一方、Dmitriy Rogachev国立医療センターは創立が1991年と比較的新しい病院です。ちなみにDmitriy Rogachevというのは、小児がんで亡くなった患者さんの名前で、病院の整備にはプーチン大統領が大きく貢献しました。
Bambino Gesu病院の年間造血細胞移植数は160例で、イタリア最大の移植数を誇っています。Dmitriy Rogachev国立医療センターには、ロシア全土から年間2000人の小児がん新患が受診し、移植数も200人に達しています。
Bambino Gesu小児病院は、自前のセルプロセッシングセンターを完備しており、自殺遺伝子を組込んだCD19CAR-Tを製造しています。自殺遺伝子は、重篤なサイトカイン放出症候群が発症した場合の対策としてCAR-T細胞に組込まれました。
2018年の1月から2019年7月までに15人の再発ALL患者に自家製CAR-T細胞が投与されました。9人は移植歴、6人はブリナツモマブの投与歴のある患者でしたが、13/15(87%)にMRD陰性のCRが得られ、治療開始18ヶ月後における全生存率は72%でした。半数の患者さんにサイトカイン放出症候群がみられましたが、自殺遺伝子を作動した患者はありませんでした。
Dmitriy Rogachev国立医療センターでは、ミルテニーバイオテク社から購入したレンチゲンという遺伝子導入ベクターを用い、同じくミルテニーバイオテク社の開発した自動細胞調整装置(CliniMACS ProdigyⓇ)でCD19CAR-T細胞を製造していますが、平均遺伝子導入効率は60%でした。31人について、投与1ヶ月後の効果を評価しましたが、27人(87%)に微小残存病変が陰性のCRが得られました。また、観察期間の中央値が223日の時点で19人は無病生存中です。
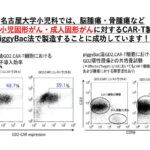
名大でも自主開発CAR-T製剤による臨床研究を実施中

キムリアのリアルワールドデータは、観察期間は短いものの、治験と同等の有望な治療成績が得られています。重篤な副作用も対応が周知されて減少しており、再発・難治性ALLの治療における有用性は確立されたと言えます。
にもかかわらず、実臨床でキムリアが投与された患者数は予想よりも少ないのは、高価格がキムリアの普及を阻んでいると思われます。自施設で製造すれば、ずっと安価に入手できることから、海外の移植病院のなかにはCAR-T製剤を自施設で製造する道を選択する施設もみられます。
これまでに、名古屋大学から紹介した4人の再発白血病患者さんは、中国でCAR-T治療を受けましたが、複数のCAR-T製剤が投与されたのにもかかわらず、薬剤費は合計でも100万円でした。ちなみに、治療費の一部を名古屋小児がん基金が助成しています。
現在、名古屋大学小児科でも、自主開発のCAR-T製剤による臨床研究を実施中です。
関連記事

小児がんへの理解と支援のシンボルです
皆様からいただいた寄付金は、最新の診断方法や治療を小児がんの子どもたちに届けるために使われます。世界最高レベルの医療をすべての子どもたちに届けるため、皆様のご支援ご協力をよろしくお願いいたします。
寄付する