RESEARCH最新の研究内容
CAR-T療法のみで白血病の治癒は可能か?長期予後は?~米国血液学会ASH2018報告~ research
米国血液学会ASH2018の報告から
小島勢二
昨年の米国血液学会、ASH 2018は 2018年12月1日から4日まで、米国のサンディエゴで開催されました。ASHは世界最大の血液学会で、世界中から25,000人を超える臨床医や基礎医学者が参加します。世界中の血液学者は、ASHに最先端の研究を発表することを目標にしています。
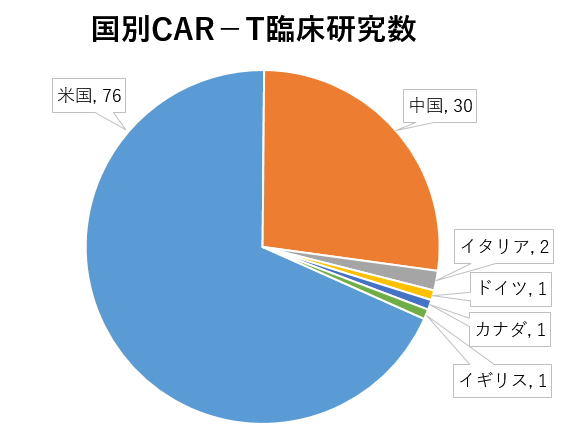
今回は、ASHで発表されたCAR-Tに関する臨床研究を中心に報告します。すでに、日経メデイカルにノバルテイス社のおこなった臨床試験の速報が掲載されていますが、ヒトを対象にした臨床試験だけでも110に達し、ひとつの発表の報告を聞くだけでは、全体像を見誤る可能性があります。110の発表の国別内訳は、米国が76、中国が30で、2つの国で大半を占めています。残念ですが、日本からの発表はありません。急性リンパ性白血病や悪性リンパ腫を対象とした研究が90演題で、多発性骨髄腫が15演題と次いでいます。今回は、急性骨髄性白血病を対象とした4演題が登場しました。
CAR-Tのみで再発/難治性B-ALLの治癒は可能か?
再発/難治性B-ALLに対して、CD19-CAR-Tは80~90%の寛解をもたらしますが、より重要なことはその長期予後です。昨年、New England Journal of Medicine誌に、CD19-CAR-Tで治療された難治性/再発B-ALLの長期予後が続いて発表されました。
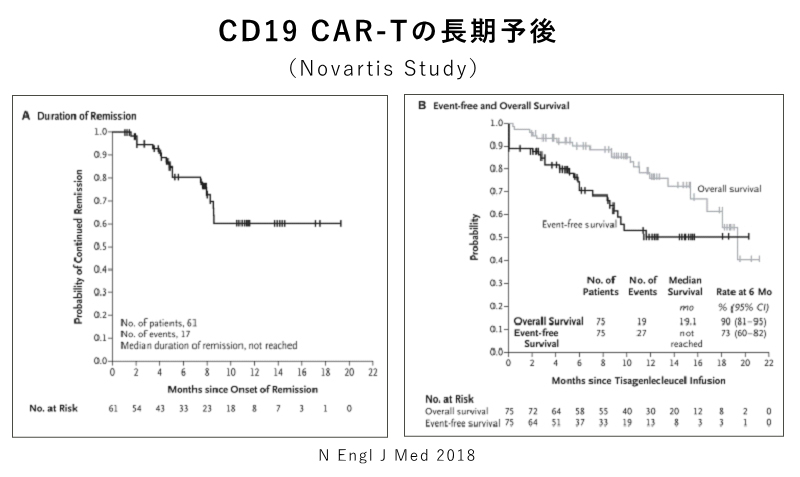
ひとつは、ノバルテイス社のCD19CAR-T製剤による小児/若年成人を対象とした臨床試験の結果で、骨髄に5%以上の白血病細胞がみられる75人の非寛解例を対象にしたのにもかかわらず、治療開始18ヶ月後の無病生存率は50%と有望な成績が得られています。寛解が得られた61人のなかで、その後に造血幹細胞移植が施行されたのは8人のみで、この8人は生存中です。16人について、再発時に白血病細胞の表面抗原を検討したところ、1人を除いて、15人ではCD19抗原が失われていました。
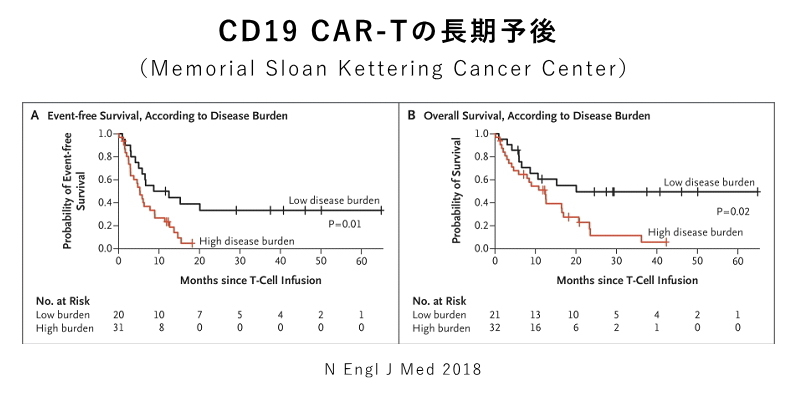
スローンケタリングがんセンターからは、19-28z CAR-Tによる成人のB-ALL53人を対象にした臨床試験の成績が報告されました。83%に完全寛解が得られたのにもかかわらず、骨髄に5%以上の白血病細胞あるいは髄外病変がみられた31例では、治療開始18ヶ月の無病生存率は5%以下でした。寛解が得られた44人のうち、17人は造血幹細胞移植が施行されましたが、生存者は5人(29%)のみで、移植されなかった26例のうち9人(35%)が生存していることを考慮すると、強化療法として、造血幹細胞移植を行うメリットは認められませんでした。
2つの報告における無病生存率の大きな相違は、CAR-Tによる非寛解例に対する治療戦略を考慮するにあたって、たいへん混乱を生じます。ノバルテイス社の治験は小児が対象であり、T細胞の活性化を増強するのに共刺激分子として4-1BBを用いているのに対して、スローンケタリングがんセンターの研究は成人が対象で、共刺激分子としてCD28を用いています。これらの違いが、2つの研究結果の大きな隔たりを説明できるか、ASH2018で報告された研究結果を用いて検討しました。
小児/若年成人における難治性/再発B-ALLに対するCD19CAR-T療法の最新解析結果(演題番号895)
先にNew England Journal of Medicine誌に掲載されたノバルテイス社のCAR-T製剤による治験結果は、そのフォローアップ期間の中央値は、13ヶ月でしたが、ASH2018では、20ヶ月にupdateされた解析結果が報告されました。寛解が得られた65人のうち、強化療法として同種移植をうけた症例は8例のみでしたが、治療開始18ヶ月後の無病生存率は、66%と優れた成績でした。
CAR-Tによる寛解後の造血幹細胞移植は再発の減少をもたらす(演題番号967)
シアトル小児病院から、小児B-ALLを対象に4-1BBを共刺激分子に用いたSCR1-CAR19v1による臨床試験の結果が報告されました。移植後の再発例ではない17人では、CAR-Tによる寛解後に移植による強化療法を受けた14人のうち、再発したのは2人のみでしたが、移植されなかった3人では、2人に再発がみられました。移植後の再発例では、10人が強化療法として2回目の移植を受けましたが、無病生存例は5人のみでした。2回目の移植を受けなかった23人のうち、無病生存例は、8人で、移植群と有意な差はみられませんでした。
なお、CAR-T輸注後63日以内に末梢血にB細胞が出現した症例は、再発リスクが高いことが知られています。B細胞が早期に出現した症例のなかで、移植されなかった6人は、全例が再発しましたが、移植された9例では、6人が生存中です。
以上の結果から、シアトル小児病院では、移植後の再発でない症例や早期にB細胞が出現した症例には、強化療法として、造血幹細胞移植を勧めています。
CD19CAR-T後の同種骨髄移植は、ハイリスク患者においても治療成績の向上に有用である(演題番号280)
中国のダオペイ病院では、CD19CAR-Tの投与を受けた83人(年齢:2-61歳)の再発/難治性B-ALL患者における予後を検討しました。62人は4-1BBを共刺激分子に用いたCAR-Tを投与し、21人はCD28を共刺激分子に用いたCAR-Tを投与しました。
CAR-T投与1月の時点で、76/83(92%)で寛解が得られ、うち70人では微小残存腫瘍(MRD)が陰性でした。なお、12ヶ月後の無病生存率は、63%でした。CAR-T投与1月後に寛解が得られた76人のうち57人は、強化療法として同種骨髄移植が施行され12ヶ月後の無病再発率は87%でしたが、移植されなかった19人の無病生存率は、わずか、8%にすぎませんでした。
この結果から、再発/難治性B−ALLにおいては、CAR-T治療のみでの治癒を期待するのでなく、同種造血幹細胞移植への橋渡しとして用いるべきと結論しています。
CAR-T治療後の再発を防ぐ試み
再発/難治性B-ALLに対するCD19CAR-T療法は、一旦は80-90%の症例で寛解が得られるものの、その後高頻度に再発することが明らかになりました。再発の原因として、1)標的となる白血病細胞表面抗原であるCD19抗原の欠失、2)末梢血からのCAR-T細胞の早期消失が考えられています。ASH2018では、再発予防の試みが多数報告されました。
1)のCD19抗原欠失に対しては、CD20, CD22,CD123などの複数の抗原をターゲットにしたdual –specific CAR-Tの投与、あるいは、CD19とCD22のCAR-Tのカクテル療法がおこなわれています。2)については、オプジーボなどの免疫チェックポイント阻害剤の併用が試みられました。
CD19xCD22 Dual-specific CAR-Tは再発/難治性B-ALLに対する抗腫瘍効果を増強する(演題番号278)
シアトル小児病院では、7人の小児ALLを対象に、CD19とCD22をターゲットにした dual-specific CAR-Tの臨床試験をおこないました。副作用も許容範囲で、生着が得られた5人では、全例で寛解が得られました。 同様のCD19/CD22 dual-specific CAR-Tの臨床試験は、中国やイギリスの施設でも行われています。
再発/難治性B細胞系腫瘍に対するCD22とCD19CAR-Tによるカクテル療法 (演題番号1408)
中国武漢にあるTongji医科大学では、88人の小児/成人の再発/難治性B-ALLあるいは悪性リンパ腫(NHL)に対して、CD22とCD19CAR-Tによるカクテル療法をおこないました。81人では最初にCD22CAR-Tを,その後CD19CAR-Tを輸注しました。CAR-Tは1度に投与するのではなく、1-5回に分割して輸注されました。
評価可能な50人のB-ALLにおいて、治療後1か月の時点で48人(96%)で寛解が得られ、うち47人(94%)では、微小残存腫瘍は陰性でした。その後、23人が再発しましたが、特筆すべきことに、CD19あるいはCD22抗原欠失が起こった症例はみられませんでした。評価可能な36人のNHLにおける反応率、完全寛解率はそれぞれ、72%と50%でしたが。3人の再発例について、生検標本の免疫染色をおこなったところ、CD19あるいはCD22抗原が欠失した症例はみられませんでした。
免疫チェックポイント阻害剤は再発B-ALLに対するCAR-Tの効果を増強する (演題番号556)
フィラデルフィア小児病院では、CD19 CAR-Tの投与後早期にB細胞が出現したり、寛解が得られなかった13人の再発B-ALLと1人のB-NHLに対して、免疫チェックポイント阻害剤の投与を試みました。サイトカイン放出症候群などの副作用も許容範囲内で、移植片対宿主病(GVHD)の出現もみられませんでした。免疫チェックポイント阻害剤の投与後、B細胞の枯渇や髄外病変の縮小がみられるなどの効果はありましたが、寛解に至った症例はありませんでした。
CD19xCD22 Dual CAR-Tにさらに免疫チェックポイント阻害剤である抗PDL1抗体遺伝子を導入した新規CAR-Tの臨床効果(演題番号277)
中国のダオペイ病院では、CD19xCD22CAR-Tに、細胞の疲弊を防ぐために、さらに抗PDL-1抗体遺伝子を導入したCAR-Tを作成しました。15人のB-ALLに投与したところ、全例で寛解が得られ、1例を除いて、微小残存病変は陰性でした。重度のサイトカイン放出症候群も1例にみられたのみで、他の副作用も軽微でした。CAR-T治療後、強化療法として同種骨髄移植が施行された10例は、その後、全例が寛解を維持して生存中です。移植を受けてない5例のうち、2例は再発しましたが、2人とも、CD19とCD22抗原の欠失は見られていません。
CAR-Tにおける新しい研究の流れ
ASH2018では、1)急性骨髄性白血病に対するCAR-Tの作成、2)同種CAR-T、3) CAR-T細胞の自動細胞調整装置の開発など、今後発展が期待される新しい研究が多数報告されました。
急性骨髄性白血病に対するCAR-Tの開発
これまでのCAR-Tの臨床研究は、B-ALL、B-NHL、多発性骨髄腫などのリンパ系腫瘍に限られていましたが、急性骨髄性白血病に対するCAR-Tの研究も急増しています。標的抗原としては、CLL1、CD33、CD123、FLT3、CD117、NKG2D、CLL-1、B7-H3などがあげられており、実際、ヒトへの投与もすでに始まっています。
NKG2D CAR-Tは前治療なしで再発/難治性急性骨髄性白血病に対して寛解をもたらす (演題番号:902)
7人の再発/難治性急性骨髄性白血病患者に抗がん剤による前治療を加えることなくNKG2D CAR-Tを投与したところ、3人(42%)で寛解が得られました。副作用としては、リンパ球減少やサイトカイン放出症候群が主なものでしたが、いずれも許容範囲内でした。
同種CAR-T
これまでCAR-Tは患者から採取したリンパ球から製造していましたが、第3者の健常人から製造したCAR-Tを予め用意しておけば、必要時にすぐ投与が可能となります。しかし、他人からのリンパ球で製造したCAR-Tでは、移植片対宿主病(GVHD)を引き起こす危険性があるので、ゲノム編集技術を用いてT細胞受容体を不活化し、HLAにかかわらず誰にでも投与可能なCAR-Tの作成が試みられています。CAR-Tは同種造血幹細胞移植の再発例に使われることがありますが、CAR-Tを1)患者自身から作成するのか、2)再発した患者の末梢血から作成するか、3)移植ドナーの末梢血から作成するのがよいかは現実的な問題です。
B-ALLに対する自己CAR-Tと同種CAR-Tの比較(演題番号:2691)
中国杭州にあるZhejiang大学では、B-ALLに対する同種造血幹細胞移植後の再発例に対してCAR-T療法をおこないました。17人は、患者自身のリンパ球から作成したauto CAR-Tを、11人は移植後のドナー由来のリンパ球から作成したRD-allo CAR-Tを, 3人はドナーから採取したリンパ球から作成した DD-allo CAR-Tを投与しました。
寛解の得られた割合は、auto CAR-Tが15/17(88%)、RD-allo CAR-Tは11/11(100%)、DD-allo CAR-Tは2/3( 66%)と変わらず、無病生存率も3群間で差は見られませんでした。急性GVHDはRD-allo CAR-Tにおいて2人(18%)、DD-allo CAR-Tでは1人(33%)にみられました。RD-allo CAR-T群では、リンパ球採取時に慢性GVHDがみられた症例は、みられない症例と比較して、有意に再発が低く、RD-allo CAR-T群はauto CAR-T群と比較して、有意に、重症なサイトカイン放出症候群の頻度も減少していました。
CAR-T細胞の完全閉鎖式自動細胞調整装置(CliniMACS Prodigy®)の登場
CliniMACS Prodigy®はミリテリバイオテック社が開発した細胞の選別や遺伝子導入、細胞増幅などの各工程を自動化した完全閉鎖式自動細胞調整装置で、細胞培養に無菌室を必要としません。ASH2018では、いくつかの施設が本装置を用いて作成したCAR-Tの臨床研究が報告されました。
スペインのバルセロナ大学では、自施設で作成したCD19レンチウイルスベクターを用いて、CliniMACS Prodigy®によるCAR-Tの製造をおこなっています。遺伝子導入効率も20%を達成しており、これまで、21人のB-ALLに自家製CAR-Tを投与しましたが、80%で寛解が得られています。重症なサイトカイン放出症候群の頻度も26%とこれまでの報告と変わりません。CliniMACS Prodigy®の登場により、今後アカデミアでCAR-Tを製造する施設の増加が予想されます。CliniMACS Prodigy®は日本でも販売されており、その価格は3000万円です。
関連記事

小児がんへの理解と支援のシンボルです
皆様からいただいた寄付金は、最新の診断方法や治療を小児がんの子どもたちに届けるために使われます。世界最高レベルの医療をすべての子どもたちに届けるため、皆様のご支援ご協力をよろしくお願いいたします。
寄付する