RESEARCH最新の研究内容
米国血液学会ASH2020の報告から:CAR-T療法を中心に research
米国血液学会ASH2020の報告から:CAR-T療法を中心に
小島勢二
ASH 2020は、2020年12月5日から9日までWEB開催されました。米国血液学会は毎年世界中からの最新の研究成果が報告されます。今回も昨年に続いて、ASH2020で発表されたCAR-T療法の最新情報を紹介します。
わが国でも、ノバルテイス社のCAR-T製剤、キムリアが市販されてから1年が経過して、わが国のリアルワールドのデータが学会で報告されるようになりました。しかし、CAR-T治療前の橋渡し化学療法や治療後の同種造血細胞移植(HSCT)の意義など数々の疑問点が生じています。先行する海外からの報告をもとに、これらの疑問点に対する回答を探してみました。とりわけ、わが国でキムリアの投与を受けた16人のうち14人(88%)は、移植後再発例であることや、5人に橋渡し治療としてブリナツマブの投与をうけていることから、移植後再発例の治療方針やブリナツマブ投与の是非について触れてみたいと思います。
英国におけるキムリアの治療成績
英国では、キムリアの投与を希望する患者は、National CAR-T cell Panel(NCCP ALL)で、適応について討議され、適応があると認められた場合は、全国に9ヶ所ある治療認定施設のうちの1つで、キムリアの投与を受けることができます。
2018年11月から2020年7月に討議された66人のうち60人がキムリアによる治療の適応ありと判断されました。リンパ球採取されたのは57人でしたが、実際にキムリアが投与されたのは49人でした。全例が治療抵抗例であり、うち47.5%には移植歴がありました。CAR-T投与からの観察期間の中央値は9.9ヶ月です。寛解率は95%で、78%は微小残存病変(MRD)が陰性でした。CAR-T投与6ヶ月後の全生存率(OS)、 無病生存率(EFS)は、それぞれ、97.6%、74.8%で、12ヶ月後のOS、EFSは86.1%、68.2%でした。
CAR-T治療後に14人(28.5%)は、造血幹細胞移植(HSCT)を受けた6人を含めて、なんらかの治療を受けています。再発した10人のうち4人では、白血病細胞の表面抗原であるCD19抗原が欠失していました。重症サイトカイン放出症候群(CRS)、神経毒性は20.4%、10.2%にみられました。また、6ヶ月、12ヶ月後でも、67.1%、51.3%に、末梢血中のB細胞の回復がみられず、ガンマグロブリンの補充を必要としました。英国におけるリアルワールドデータは、治験のデータと比較して、有効率や安全性において良好な結果でした。
CAR-T投与時の骨髄における白血病細胞の割合が予後に影響する
リアルワールドCAR-Tコンソーシウムの検討から
15病院から集めた185人のキムリア投与例について、キムリア投与時の骨髄白血病細胞の割合と予後との関連が検討されました。患者背景として、年齢および観察期間の中央値は12歳(0~26歳)、11.2ヶ月(0.2~28.8ヶ月)でした。CAR-T投与1ヶ月後の寛解率は85%であり、うち97%は微小残存病変(MRD)が陰性でした。35%が再発しましたが、うち41%はCD19抗原が欠失していました。CAR-T投与後6ヶ月の全生存率(OS)、無病生存率(EFS)は、それぞれ、85%、64%で、12ヶ月後のOS、EFSは72%、51%でした。重症サイトカイン放出症候群(CRS,) 重症神経毒性は19%と7%にみられました。
CAR-T輸注時の骨髄白血病細胞の割合が5%以上、あるいは末梢血に白血病細胞の出現や髄外病変がみられる場合をHB群(51%)、白血病細胞はみられるも上記の基準を満たさない場合をLB群(22%)、白血病細胞がみられない場合をNDD群(25%)と定義しました。形態学的な寛解率は、HB群、LB群、NDD群で、それぞれ、51%、98%、96%でした。6ヶ月のOSは75%(HB群)、94%(LB群)、98%(NDD群)、EFSは50%(HB群)、86%(LB群)、75%(NDD群)でした。12ヶ月のOSは58%(HB群)、85%(LD群)、95%(NDD群)で、12ヶ月のEFSは34%(HB群)、69%(LB群)、72%(NDD群)でした。CAR-T輸注時に、骨髄が寛解状態であることが、予後の改善につながりました。
CAR-T治療前にブリナツマブを投与すると再発が増加する
CAR-T治療前のブリナツマブ投与歴が予後に影響するかを検討しました。2012年から2019年の間に7病院でCAR-Tが投与された420人が研究対象です。CAR-T投与時の年齢中央値(範囲)は12.4歳(0.6~30歳)でした。評価可能な412人のうち、375人(91.0%)に寛解が得られ、うち363人(96.8%)については、微小残存病変(MRD)が陰性でした。経過観察期間の中央値(範囲)は2.3年(1.6~3.3年)でしたが、この期間に164人(43.7%)が再発しました。75人(17.8%)に、ブリナツマブの投与歴があり、ブリナツマブの最終投与からCAR-T投与までの期間の中央値(範囲)は、129日(79~304日)でした。
ブリナツマブ投与群の寛解率は58/71(82%)で、非投与群の317/341(93%)と比較して統計学的に有意に劣っていました。同様に、ブリナツマブ投与群のCAR-T投与6ヶ月後の無病生存率(EFS)は49.7%と、非投与群の72.1%と比較して劣っていました。CAR-T投与前にフローサイトメトリーで白血病細胞におけるCD19抗原の発現を検討したところ、CD19抗原の発現が低下あるいは消失している患者の割合は、ブリナツマブ投与群では6/69(13%)と非投与群の21/339(6.2%)と比較して増加していました。
CAR-T投与によって化学療法抵抗性微小残存病変は消失する
ALLの治療において、化学療法後に微小残存病変(MRD)が残存している場合は、極めて予後不良です。天津医科大学では、化学療法後にMRDが残存する14人の成人ALL患者(年齢:13~62歳)に対して、CAR-T療法の効果を検討しました。
1回のCAR-T投与で12人(85%)においてMRDは消失しました。5人のフィラデルフィア染色体陽性ALL患者には、その後、同種骨髄移植が施行されました。2人は、移植関連合併症で死亡しましたが、残り3人は無病生存中です。一方、9人のフィラデルフィア染色体陰性ALL患者は1人を除いて、同種造血幹細胞移植を受けずに経過観察されました。4人は再発しましたが、残り4人は12~28ヶ月間寛解を維持しています。CAR-T投与から2年後の無病および全生存率は、それぞれ、61%、78%でした。
CAR-T療法は睾丸単独再発にも有効である
ALLの骨髄以外の再発部位としては、中枢神経系や睾丸再発の頻度が高いことが知られています。天津血液病院センターでは、7人の睾丸単独再発例に対して、睾丸摘出や放射線照射をすることなくCAR-T投与のみで治療しました。7人の年齢の中央値(範囲)は、9歳(2~10歳)で、CAR-Tの投与回数は、1回のみでした。6人が寛解に至り、睾丸の大きさは正常化しました。1人は、その後、骨髄再発しました。寛解持続期間の中央値(範囲)は14ヶ月(5~23ヶ月)で、CAR-T投与12ヶ月の時点での、無病生存率は83%でした。
中枢神経系再発病変のある小児ALLに対するCAR-T療法の効果と安全性
8病院で経験した中枢神経系に再発した27人のALL患者について、CAR-T療法の効果と安全性を検討しました。15人については移植歴があり、7人は全身放射線照射を、4人は頭蓋放射線照射を受けていました。10人は中枢神経系単独再発であり、17人は中枢神経系と骨髄の同時再発でした。
脳脊髄液中の細胞数の中央値(範囲)は65(0~5670)です。CAR-T投与前の橋渡し治療としては、抗がん剤の髄注単独、あるいは全身化学療法、放射線照射との併用療法が行われ、15人については脳脊髄液から白血病細胞は消失しましたが、12人では白血病細胞は残存していました。15人は4-1BB CAR-Tを、12人にはCD-28CAR-Tが投与されました。
サイトカイン放出症候群はCD-28CAR-Tが投与された12人では全例に、4-1BBCAR-Tが投与された8人(53%)にみられました(p=0.006)。神経毒性もCD-28CAR-T投与群の9人にみられましたが、4-1BBCAR-T投与群では3人にみられたのにすぎませんでした(p=0.004)。CAR-T投与時に脳脊髄液から白血病細胞が残存していた群では9人(75%)に神経毒性がみられましたが、消失していた群では3人(20%)でした(p=0.004)。
CAR-T投与後、評価可能な26人のうち、24人(92%)で、完全寛解が得られました。CD-28CAR-Tを投与された9人には、その後、同種造血幹細胞移植が施行されました。最終的に6人が再発しましたが、そのうち4人は骨髄再発、2人は中枢神経系再発でした。
CAR-T療法後の寛解維持には同種造血幹細胞移植移植が必要である
2018年8月から2020年3月の間に米国のセントジュード小児研究病院でCAR-T療法を受けた22人について、CAR-T療法後の同種造血幹細胞移植(HSCT)の有無でその後の予後に違いがあるかを検討しました。患者年齢の中央値(範囲)は12.3歳(1.8~23.5歳)で、CAR-T投与時の骨髄白血病細胞の割合の中央値(範囲)は、6.8%(0.003~100%)でした。12人にはセントジュード小児研究病院が自施設で製造したCAR-T製剤を、10人にはキムリアが投与されました。
CAR-T投与4週後の評価で15人(68.2%)に寛解が得られ、うち13人は微小残存病変(MRD)が陰性でした。次世代シークエンサーによるMRDが陽性であった1人は、CAR-T投与50日後に再発し、他の1人は、CAR-T投与35日後に真菌感染症で死亡しました。
MRDが陰性の6人は、CAR-T投与1.8~2.9ヶ月の時点でHSCTを受けましたが、全例が寛解を維持して生存中です。観察期間の中央値(範囲)は238日(19~441日)でした。一方、HSCTが施行されなかった7人のうち1人は、CAR-T投与後1年間以上寛解を維持していますが、残りの6人はCAR-T投与2~9ヶ月後に再発しました。再発した5人のうち4人については、白血病細胞表面のCD19抗原の欠失は見られませんでした。
重症サイトカイン放出症候群は4人に、重症神経毒性は3人にみられました。CAR-T投与12ヶ月後の無病生存率、全生存率はそれぞれ25%、70%でした。また、セントジュード製剤とキムリアの間で予後について、違いは見られませんでした。
CAR-T療法後の同種造血細胞移植はCAR-T療法後の長期予後を改善する
2017年4月から2020年4月までの3年間に、中国のLu Daopei病院で移植後の再発例に対してCAR-T療法が施行された23人の予後を検討しました。患者年齢の中央値(範囲)は、20歳(3~58歳)でした。初回移植のドナーは、HLA一致兄弟(5人)、非血縁ドナー(1人)、ハプロ一致ドナー(17人)でした。18人(78%)は、移植後6ケ月以内の早期再発例でした。初回移植からCAR-T投与までの期間の中央値(範囲)は261日(117~2181日)、CAR-T投与時の骨髄白血病細胞の割合の中央値(範囲)は、72.5%(1.5~94.5%)で、5人は90%以上でした。全員、CAR-T投与時には、急性GVH Dはコントロールされていました。CAR-Tの製造に、15人は移植ドナーから、8人は患者本人のリンパ球が使われました。なお、2人には、CAR-Tが2回投与されました。CAR-T投与後、2回目の移植には、15人は全身放射線を含む前治療が、7人はブスルファンを含む前治療が選択されました。
CAR-T投与30日後の時点で、全例に微小残存病変(MRD)陰性の寛解が得られました。重症サイトカイン放出症候群は2人(8.7%)に、重症神経毒性は3人(13%)に見られました。全例に、CAR-T投与後中央値(範囲)で67日(39~329日)後に、2回目の同種造血幹細胞移植が施行されました。移植ドナーは2人が非血縁ドナーで、それ以外はハプロ一致ドナーです。移植後、4人は感染症、1人はGVHDで死亡しましたが、それ以外の18人は、再発なく生存中です。移植後の経過観察期間の中央値(範囲)は258日(84~978日)で、1年、2年後の全生存率は、それぞれ、68%、54%でした。ドナー由来のCAR-Tの方が患者本人から製造したCAR-Tよりも全生存率が良い傾向がみられました。また、2回目の移植後、4人についてはGVHDが発症しました。
CAR2.0療法による移植後再発ALLの治療
中国深センにある遺伝子免疫医学研究施設(GIMI)が開発した移植後再発ALLに対するCAR2.0療法の治療成績を検討しました。CAR2.0療法では、治療対象となる患者白血病細胞の表面マーカーの検査結果に応じて使用するCAR-T製剤を選択します。CAR-T製剤としては、CD19抗原に対応するCAR-Tの他、CD22、CD123、CD38抗原に対応するCAR-T製剤が用意されています。なお、CAR-T製剤には、重症なサイトカイン放出症候群を発症した時の備えとしてCasp9自殺遺伝子を組み込んでいます。CAR-Tを製造するリンパ球については、16人の移植ドナーから、4人は患者からから採取しました。
20人がこの治療を受けましたが、11人は18歳以下で、7人はフィラデルフィア染色体が陽性でした。CAR-T治療前に、7人は中等症以下の活動性GVHDに罹患していました。また、4人は単独の髄外再発例、2人は髄外と骨髄再発例でした。CAR-T投与時の骨髄白血病細胞の割合は、5人は10%以上、8人は3%以下で、7人は微小残存病変(MRD)が陰性の寛解期に治療されています。
CD19CAR-Tのみ投与された11人では、10人が微小残存病変(MRD)陰性の寛解を達成しました。残りの9人には、CD19CAR-Tに加え、CD22、CD123、C D38CAR-Tのいずれかが併用されましたが、8人で寛解が得られました。重症サイトカイン放出症候群の発症は1人もみられませんでした。移植ドナー由来のCAR-Tが投与された5人に中等症以下のGVHDが発症しましたが、全例コントロール可能でした。
CAR-T投与2ヶ月以内に、18人において、MRD陰性の寛解が得られました。1人もCAR-T投与後に同種造血幹細胞移植を受けた患者はいませんが、再発例は4人のみで、14人は、寛解を維持しており、うち6人は1年以上経過しています。
CD19/CD22 Dual CAR-Tを24時間以内に製造する方法を確立

CAR-Tの製造には通常1~2週間を必要とします。キムリアにおいては、採取したリンパ球を米国の工場で加工した後に、再び日本に返送されるので、リンパ球を採取してからCAR-Tを投与するまでに1~2ヶ月かかっており、その間に状態が悪化して投与を断念せざるを得ない場合もあります。中国のバイオベンチャーであるGracell Biotechは、24時間以内に、CD19/CD22 Dual CAR-Tを製造する方法を確立し、Lu Daopei病院で、この製剤を用いた臨床試験を実施しました。Dual CAR-TとはCD19抗原とCD22抗原を同時に攻撃できるように造られた製剤です。
2019年11月から2020年8月までの期間に、11人がこの研究に参加しました。患者年齢の中央値(範囲)は11歳(3~48歳)で、1人を除いては小児です。臨床研究に登録された時点での、骨髄白血病細胞の割合の中央値(範囲)は、42%(0~73%)でした。3人にはCD19CAR-Tの投与歴が、1人は同種造血幹細胞移植(HSCT)を受けており、1人はCD19CAR-TとHSCTによる治療歴がありました。
骨髄の白血病細胞の割合が5%以上あった7人のうち、6人で微小残存病変(MRD)が陰性の寛解が得られました。骨髄の白血病細胞の割合が5%未満の4人では、3人でMRDが陰性の寛解が得られました。
CAR-T投与後にHSCTを受けた6人では、1人がGVHDで死亡しましたが、残りの5人は、MRD陰性の寛解を維持しています。HSCTを受けなかった5人では、1人がCAR-T投与後4ヶ月間MRD陰性の寛解を維持していますが、残り4人は、形態学的あるいはMRDレベルで再発しました。重症サイトカイン放出症候群を発症したのは、1人のみでした。
小島コメント
わが国では、この1年間、厳密な適応基準に従って、キムリアが投与されてきましたが、今回の米国血液学会に発表された海外からの研究報告では、日本の適応基準よりも広い範囲でCAR-Tが投与されていました。微小残存病変陰性例を含め骨髄が完全寛解の症例さらには髄外単独再発例もCAR-Tが投与されています。
わが国においてもCAR-Tによる治療例は、造血幹細胞移植(HSCT)後の再発例が多くみられますが、移植後再発例に対して、海外ではCAR-Tのソースとして移植ドナーのリンパ球が選択されることが多く、患者由来のリンパ球で製造したCAR-Tよりも、予後が良好な傾向にあるようです。わが国では、移植ドナーのリンパ球からCAR-Tを製造することはあまり聞いたことはありませんので、この点に関して、わが国の現状を調査する必要があると思います。
最も議論を必要とする点は、CAR-T投与後のHSCTの必要性です。多くの施設では、CAR-T治療で寛解が得られた後に、HSCTを追加していますが、深セン遺伝子免疫医学研究施設(GIMI)のように、CAR-T投与のみで再発が抑えられている施設もあります。GIMIでは骨髄MRD陰性症例にCAR-Tを投与している他、患者白血病細胞の表面抗原に併せて、CD19CAR-Tのみでなく、複数のCAR-Tを投与しています。実際、GIMIにCAR-T治療を依頼した名古屋大学からの紹介例も、移植後再発例でしたが、HSCTの追加なく4年間寛解を維持しています。現状では、CAR-Tで寛解が得られた後にHSCTを行うか、分子標的薬を含めてあらゆる方法で骨髄でのMRD陰性を達成してからCAR-Tを投与するかの選択が、CAR-T治療後の再発防止には必要と思われます。
現在、米国の小児がんグループ(COG)は、初回寛解導入後も骨髄MRDが陽性のハイリスクALL症例を対象にキムリアの治験(CASSIOPEIA試験)を開始しています。5年前に私が夢想した治療が実現に向かっています(図)。
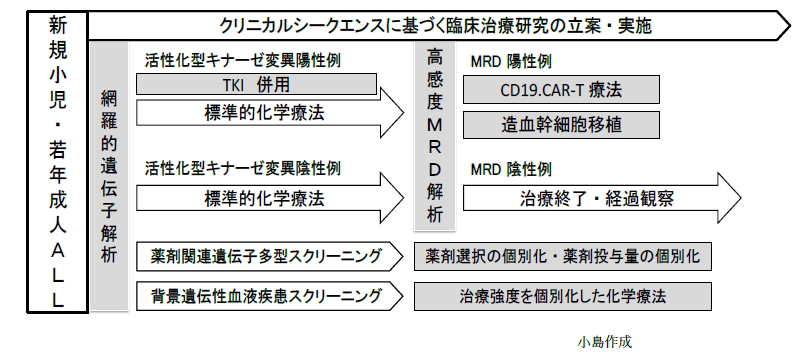
しかし、CAR-T療法は、まだ駆け出しの治療法であり、今回の米国血液学会の研究発表にみるように、アカデミアによる研究成果をもとにさらなる治療法の改善が必要な分野で、キムリアの登場で問題が解決されたわけではありません。
関連記事

小児がんへの理解と支援のシンボルです
皆様からいただいた寄付金は、最新の診断方法や治療を小児がんの子どもたちに届けるために使われます。世界最高レベルの医療をすべての子どもたちに届けるため、皆様のご支援ご協力をよろしくお願いいたします。
寄付する






